ANALYSE D'ARTICLE
Activation synergique du récepteur des xénobiotiques PXR par l’éthinylestradiol et le trans-nonachlor
Cette étude met en évidence l’action synergique sur le récepteur nucléaire PXR de deux xénobiotiques : le 17α-éthinylestradiol (œstrogène des pilules contraceptives) et le trans-nonachlor (pesticide organochloré inscrit à la convention de Stockholm sur les polluants organiques persistants). Montrant que ces deux activateurs faibles de PXR se combinent en un ligand à forte affinité, elle révèle l’origine d’un effet « cocktail » par lequel la toxicité de deux substances individuellement peu actives est exacerbée.
This study highlights the synergistic activation of the PXR nuclear receptor by two xenobiotics: 17α-ethinylestradiol (an estrogen commonly used in contraceptive pills) and trans-nonachlor (an organochlorine pesticide listed under the Stockholm convention as a persistent organic pollutant). Showing that these two low PXR activators combine in a high-affinity ligand, it reveals a cocktail effect by which compounds toxicity is exacerbated.
Les connaissances relatives aux effets des perturbateurs endocriniens reposent majoritairement sur des études expérimentales dans lesquelles les substances ont été évaluées une à une. Rares sont les travaux mimant mieux la situation réelle : l’exposition simultanée à de faibles doses de nombreux xénobiotiques (polluants, médicaments, aliments) parmi lesquels certaines substances à action endocrinienne pourraient interagir. L’évaluation des risques de l’exposition à des mélanges se heurte à la multiplicité des combinaisons potentielles, mais aussi à la méconnaissance des mécanismes moléculaires sous-tendant les effets « cocktail ». À ce titre, l’apport de cette étude in vitro est important.
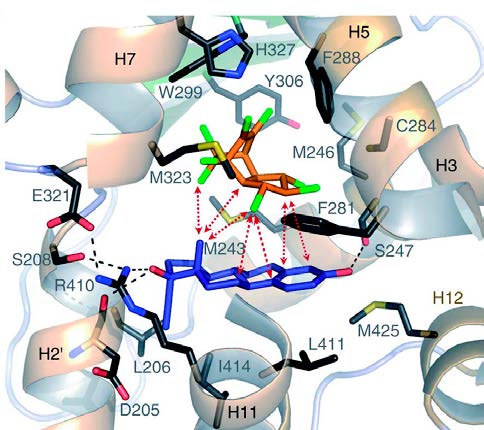
Synergie d’action de deux xénobiotiques
La littérature accumulée sur les perturbateurs endocriniens met en lumière le rôle pivot de récepteurs nucléaires sur la voie conduisant à plusieurs types d’effets (métaboliques, prolifératifs, reprotoxiques). Ces protéines qui régulent l’expression de gènes dans le noyau des cellules contiennent des domaines de liaison pour divers ligands métaboliques et hormonaux, la liaison activant leur fonction de facteur de transcription. En se substituant à un ligand naturel, un perturbateur endocrinien dérègle la voie de signalisation intracellulaire médiée par le récepteur.
Commentaires
Cet article est extrêmement intéressant. L’effet synergique original découvert par les auteurs pourrait remettre en question bien des dogmes sur les conditions requises pour activer des récepteurs nucléaires, si importants dans le fonctionnement cellulaire. Le projet européen EuroMix (https ://www.euromixproject.eu/), débuté il y a à peine un an, devrait se pencher sur ces résultats et les approfondir (l’équipe TOXALIM de l’INRA (Institut national de la recherche agronomique), co-auteur de l’article, est impliquée dans ce projet). Il y a en effet loin de la coupe aux lèvres en perturbation endocrinienne : l’activation (même synergique) d’un récepteur ne se traduit pas forcément par un effet significatif au niveau du corps entier. Les systèmes hormonaux ont précisément évolué pour réguler des fonctions physiologiques extrêmement importantes et sont très robustes aux perturbations. Décider du caractère perturbateur endocrinien d’une substance (ou d’un mélange) sur la base d’un seul événement moléculaire initiateur relève d’une approche de précaution fondée sur le danger, plus que d’une approche d’évaluation des risques. Le danger du mélange étudié ici est donc bien établi, mais (et les auteurs en sont bien conscients, puisqu’ils le mentionnent) des études supplémentaires seront nécessaires pour établir le niveau de risque encouru par les personnes exposées au mélange. On conçoit aisément la complexité de la tâche qui consiste à évaluer les dangers des mélanges de substances (incroyablement plus divers que les substances seules) pour déboucher sur des mesures de précaution. Il est encore plus difficile d’évaluer les risques correspondants, même si l’on se limite aux mélanges présentant un danger. Une telle évaluation est cependant nécessaire si l’on ne veut pas se figer dans une attitude intenable d’évitement de tout danger. C’est sans doute le plus grand défi lancé à la toxicologie depuis 50 ans. Les progrès sont lents car la question est extrêmement complexe (il est plus facile et plus vendeur d’envoyer quelqu’un sur Mars que de la résoudre...), mais toute avancée sur la compréhension des mécanismes, comme celle offerte par cet article, donne une arme supplémentaire à l’arsenal défensif de la toxicologie prédictive.
Frédéric Bois
Les auteurs de cette étude se sont intéressés à l’un de ces récepteurs nucléaires, PXR (pregnane X receptor), qui a été identifié comme jouant un rôle de première ligne dans la défense de l’organisme contre les substances étrangères. Activé par des xénobiotiques tels que le bisphénol A, des pesticides organophosphorés, des alkyphénols ou la rifampicine, PXR interagit avec des coactivateurs transcriptionnels (notamment SRC-1 : steroid receptor coactivator-1) pour induire la surexpression de gènes de détoxication majeurs tels que CYP3A4, qui code pour un cytochrome P450, enzyme impliquée dans le métabolisme de plus de la moitié des médicaments.
Dans un premier temps, les auteurs ont évalué le potentiel agoniste de 40 substances chimiques, seules ou en mélanges binaires, par rapport à un activateur puissant de PXR représentant la substance de référence (SR12813 utilisé en thérapeutique comme hypocholestérolémiant). Alors que l’effet de la plupart des combinaisons était de type additif et moins puissant que celui du SR12813 (niveau d’induction compris entre 50 et 60 %), l’effet du mélange de 17α-éthinylestradiol (EE2) et de trans-nonachlor (TNC) était synergique et pratiquement équivalent à celui de l’agoniste complet (niveau d’induction de 90 %). Cette synergie mise en évidence dans la lignée cellulaire humaine HeLa (utérus) a été confirmée dans deux autres lignées carcinomateuses : HepG2 (foie) et LS174T (côlon). Des manipulations successives, utilisant la lignée LS174T puis une culture d’hépatocytes fraîchement isolés (meilleur modèle biologique fonctionnel pour PXR), ont montré l’augmentation considérable de l’expression de CYP3A4 quand la seconde substance était ajoutée au milieu contenant la première. Dans une autre série d’expériences, la combinaison d’EE2 et de TNC s’est montrée capable d’augmenter fortement le recrutement du co-activateur SRC-1 (l’effet étant similaire à celui du SR12813) alors que chaque substance isolément développait un effet modeste.
Interaction des deux substances dans PXR
Les auteurs ont ensuite déterminé l’affinité de l’EE2, du TNC et du mélange pour le récepteur, puis mis en évidence l’augmentation de l’affinité de chaque substance après pré-incubation du récepteur avec l’autre. Les données produites ont amené l’hypothèse d’une coopération entre les deux composés (la liaison du premier favorisant celle du second) au sein de la poche de liaison du récepteur. Cette hypothèse a été appuyée par l’analyse cristallographique à haute résolution de cette structure, qui a révélé des interactions de van der Waals entre les deux ligands, entraînant leur stabilisation mutuelle. L’assemblage moléculaire ainsi créé, qui remplit largement la poche de liaison, peut être vu comme un ligand “supramoléculaire” dont les propriétés fonctionnelles (affinité et activité) rejoignent celles d’un agoniste complet tel que le SR12813 ou la rifampicine.
Plusieurs études de structure indiquent que la notion de sites de liaison précisément adaptés à un ligand spécifique ne s’applique pas aux récepteurs nucléaires comme PXR ou PPARγ (peroxisome proliferator- activated receptor gamma) qui possèdent une large poche capable de contenir plusieurs molécules simultanément. Celles de récepteurs tels qu’ERα (récepteur des oestrogènes), TRß (récepteurs des hormones thyroïdiennes) ou GR (glucocorticoïdes) apparaissent flexibles et capables de changer de conformation pour accepter un ligand plus volumineux que l’hormone endogène. Étant donné la plasticité des poches de liaison des récepteurs de la superfamille des récepteurs nucléaires, le mécanisme décrit ici pour expliquer la synergie d’action de l’EE2 et du TNC sur PXR (qui nécessite d’être vérifiée par des études in vivo) pourrait concerner d’autres combinaisons sur d’autres récepteurs.
Laurence Nicolle-Mir
Publication analysée :
Delfosse V, Dendele B, Huet T, et al. Synergistic activation of human pregnane X receptor by binary cocktails of pharmaceutical and environmental compounds. Nat Com 2015; 6: 8089.
Inserm U1054, Montpellier, France.
doi : 10.1038/ncomms9089



