ANALYSE D'ARTICLE
Le cryptochrome : un acteur clé du mécanisme d’action biologique des champs magnétiques ?
Identifiant la production d’espèces réactives de l’oxygène lors de l’activation des cryptochromes comme une réponse biologique universelle à l’exposition à des champs magnétiques de faible intensité, les auteurs de l’article princeps estiment que ce mécanisme peut expliquer des effets bénéfiques comme délétères de l’exposition, selon qu’elle génère un stress oxydant modéré ou excessif. Reprenant l’adage « des affirmations extraordinaires exigent des preuves extraordinaires », les auteurs de l’article de commentaire publié simultanément appellent à interpréter ces résultats expérimentaux avec prudence en évitant toute extrapolation hâtive.
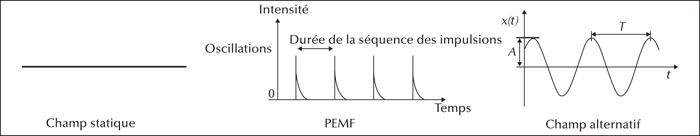
Les champs magnétiques de faible intensité (du micro au milliTesla) sont tantôt accusés d’effets sanitaires délétères (champs induits par les lignes de transport de l’électricité à haute tension et les technologies de communication sans fil notamment), tantôt auréolés d’effets bénéfiques fondant la thérapie par champs électromagnétiques pulsés (CEMP) proposée pour l’ostéoporose, l’arthrose, des maladies neurodégénératives, la dépression, etc. Comble du paradoxe, les applications thérapeutiques des champs magnétiques de faible intensité s’étendraient au cancer, alors qu’ils sont classés parmi les agents possiblement cancérogènes pour l’homme par le Centre international de recherche sur le cancer (Circ). L’absence de mécanisme d’action clairement identifié alimente le scepticisme et la controverse.
Celui décrit par Sherrard et al. pourrait contribuer à y mettre fin. L’avancée est saluée par les deux auteurs de l’article de commentaire, qui rappellent toutefois que la portée de cette découverte dépendra de la réplication des résultats par des équipes indépendantes.
L’hypothèse du cryptochrome
Les cryptochromes sont des flavoprotéines héritées de l’évolution, mises en évidence dans diverses espèces végétales comme animales, incluant les oiseaux migrateurs pour lesquels ils se présentent comme une explication au phénomène d’orientation géomagnétique. L’activation des cryptochromes aviaires nécessite une stimulation rétinienne par la lumière bleue qui initie la cascade des réactions d’oxydoréduction de la flavine au cours desquelles des paires radicalaires sont formées par transferts d’électrons entre résidus tryptophanes principalement. Ces paires peuvent être à l’état singulet (deux électrons de spin opposé) ou triplet (deux électrons de même spin), le champ magnétique ambiant influençant le rapport entre les deux états, lequel influencerait à son tour la production d’espèces réactives de l’oxygène (ROS).
Si l’accumulation locale de ces métabolites est cytotoxique par dommages aux membranes cellulaires, aux acides nucléiques et aux protéines, les ROS présents à un niveau de concentration modérée stimulent les processus de défense et de réparation cellulaires. La modulation du niveau des ROS intracellulaire via l’activation des cryptochromes pourrait ainsi expliquer des effets sanitaires variables, tantôt nocifs, tantôt bénéfiques du champ magnétique, dépendant des conditions d’exposition, pour peu que les cryptochromes humains soient également magnétosensibles.
Or, si les cryptochromes de mammifères ont été identifiés à la fois dans les compartiments nucléaire et cytosolique des cellules, et qu’ils semblent être des éléments importants de l’horloge biologique circadienne, leur activation n’apparaît pas dépendre d’un stimulus lumineux initial et leur magnétosensibilité restait à démontrer.
Première étape
Les auteurs ont utilisé la mouche drosophile comme modèle animal pour leur première série d’expérimentations. Des insectes adultes de souches sauvages, déficientes en cryptochrome endogène (DmCry) et d’une souche transgénique (dépourvue du DmCry mais dotée du cryptochrome humain HsCry1) ont été laissés pendant 24 h au contact de boîtes de Pétri carrées (12,5 × 12,5 cm) pour la dépose des œufs. Les boîtes ont ensuite été placées sous lumière bleue ou rouge durant trois jours, puis une bobine délivrant un CEMP en continu (fréquence 10 Hz, pic d’intensité du champ magnétique 2 mT) a été placée à l’un des coins pendant cinq jours au cours desquels les larves ont migré jusqu’au lieu de leur choix pour poursuivre leur développement. La répartition des pupes montre que les larves de souches sauvages préalablement exposées à la lumière bleue ont évité l’angle soumis au champ magnétique, alors que les pupes de souches déficientes sont fixées aux quatre coins dans des proportions équivalentes. Le comportement d’éviction des larves de la souche transgénique est comparable à celui des larves de souches sauvages, ce qui indique qu’elles ont tout autant détecté le champ magnétique.
Les auteurs de l’article de commentaire notent l’effort de constitution de groupes témoins de qualité, dont l’absence est le principal défaut de l’abondante littérature expérimentale soutenant l’intérêt thérapeutique des CEMP en rapportant divers effets cellulaires comme la stimulation de la production de facteurs de trophicité ou l’inhibition de l’apoptose. Deux méthodes restant toutefois imparfaites (n’excluant pas l’exposition à la chaleur et aux vibrations) ont été appliquées pour former des groupes témoins négatifs : l’insertion d’un écran métallique entre la bobine émettrice et la paroi de la boîte de Pétri, et l’utilisation d’une bobine à double sens de circulation du courant électrique.
Mise en évidence de la production de ROS
Les manipulations suivantes ont confirmé la synthèse de ROS sous l’effet de la stimulation magnétique et son caractère cryptochrome dépendant. Deux approches complémentaires ont été utilisées : l’imagerie (détection fluorométrique des ROS) et l’analyse du transcriptome (mesure du niveau d’expression des gènes). Outre des cellules de drosophile, les auteurs ont utilisé du matériel murin, ainsi que des cellules humaines embryonnaires de rein (HEK293).
Ces dernières ont été cultivées dans des conditions identiques pendant 48 h en présence ou en l’absence du même CEMP que précédemment avant la mesure de la concentration de peroxyde d’hydrogène (H202) dans le milieu de culture et le comptage cellulaire. Leurs résultats (concentration plus élevée d’H202 et moindre prolifération cellulaire dans le groupe exposé) sont compatibles avec un effet toxique de l’exposition prolongée à un champ magnétique. Ils ne sont pas observés dans une lignée cellulaire transfectée par un plasmide invalidant l’expression des deux types de cryptochromes humains (HsCry1 et HsCry2). Dans la lignée compétente soumise à une stimulation par CEMP durant 3 h, l’analyse du transcriptome indique que pour 75 % des gènes dont le niveau d’expression est modifié (au total 488 gènes surexprimés et 80 sous-exprimés), le promoteur contient des sites de liaison à des facteurs de transcription sensibles aux variations de la concentration intracellulaire de ROS. La comparaison des données transcriptomiques à celles de l’imagerie (montrant une augmentation du niveau des ROS dans les nucléoles comme dans les structures vésiculaires de la cellule : appareil de Golgi et réticulum endoplasmique) s’accorde avec la double localisation nucléaire et cytosolique des cryptochromes.
S’étendant à des considérations cliniques, les auteurs estiment que leurs résultats fournissent un rationnel à l’optimisation de l’usage thérapeutique de la stimulation par des champs magnétiques de faible intensité. Sur l’autre versant, tout en reconnaissant l’absence de preuve épidémiologique solide d’un effet pathogène de ces champs, ils évoquent une synergie d’action possible avec d’autres agents environnementaux stimulant la production intracellulaire de ROS.
Pour les auteurs de l’article de commentaire, si le protocole expérimental mis au point peut servir de fondation pour interroger les bases moléculaires de la magnétoréception, des points importants restent à éclaircir pour valider l’implication du cryptochrome dans ce phénomène et comprendre l’influence du champ magnétique sur les systèmes biologiques.
Commentaires
Le but de cette étude (Sherrard) est de montrer par des expériences biochimiques et d’imagerie que l’exposition des cellules de mammifère à de faibles champs électromagnétiques pulsés (PEMF) stimule l’accumulation rapide d’espèces réactives de l’oxygène (ROS), un métabolite toxique potentiel qui a de multiples rôles dans la réponse au stress et le vieillissement cellulaire.
Les auteurs concluent que la modulation des ROS intracellulaires via les cryptochromes représente une réponse générale aux champs électromagnétiques faibles, ce qui peut expliquer des conséquences thérapeutiques ou pathologiques : « Cela fournit un mécanisme par lequel les vitesses de réaction des cryptochromes et les rendements en produits peuvent être modifiés par des champs magnétiques ».
Les cryptochromes des mammifères semblent fonctionner indépendamment de la lumière dans son rôle d’horloge circadienne, en tant que régulateurs négatifs de la transcription ; d’où les auteurs déduisent que le mécanisme est le même que chez les insectes.
L’éditeur a tenu à accompagner cette publication d’une expertise complémentaire (Landler) qui aborde des considérations sur l’état des connaissances et des systèmes expérimentaux sur le terrain, encourageant une interprétation prudente de ces résultats tout en soulignant que « si cela est correct, il est concevable que la cancérogenèse associée à lignes à haute tension, la génération de ROS induite par la PEMF et la magnétoréception animale partagent une base mécaniste ».
Il convient toutefois de noter que le champ magnétique terrestre qui guide les oiseaux est statique, que les expérimentations sont faites avec des champs pulsés, et que le courant électrique est alternatif. Il faudrait donc continuer ces expérimentations avec un champ alternatif pour voir s’il interagit de la même manière que le champ pulsé avant de porter des conclusions.
Pierre-André Cabanes
Publication analysée :
* Sherrard RM1, Morellini N, Jourdan N, et al. Low-intensity electromagnetic fields induce human cryptochrome to modulate intracellular reactive oxygen species. PLoS Biol 2018 ; 16 : e2006229. doi : 10.1371/journal.pbio.2006229
1 Sorbonne Université, CNRS Unit Biological Adaptation and Ageing, Team Repairing Neural Networks, Paris, France.
# Landler L1, Keays DA. Cryptochrome: the magnetosensor with a sinister side? PLoS Biol 2018 ; 16 : e3000018. doi : 10.1371/journal.pbio.3000018
1 Research Institute of Molecular Pathology, Vienna Biocentre, Vienne, Autriche.