Synthèse publiée le : 17/05/2022
SYNTHESE :
La transmission des virus respiratoires
dans les environnements intérieurs
Un virus respiratoire peut être transmis d’une personne infectée à une personne exposée selon plusieurs voies : par contact direct entre ces deux personnes, par l’intermédiaire de surfaces ou d’objets contaminés (nommés fomites en anglais), par projection de grosses gouttelettes contaminées sur les conjonctives ou les muqueuses respiratoires de la personne exposée se trouvant à proximité (mode de transmission dit « gouttelettes ») ou par inhalation de particules en suspension dans l’air de moins de 100 µm sous forme d’aérosol. Les mécanismes de cette dernière voie font l’objet de cet article.
Il est primordial, pour chaque virus respiratoire, d’identifier parmi ces quatre modes de transmission ceux qui ont une contribution significative et si un mode est prépondérant au regard des autres afin d’adapter les mesures de protection contre la propagation de l’infection. Dans le cas du virus respiratoire SARS-CoV-2 (coronavirus 2 du syndrome respiratoire aigu sévère), agent responsable de la maladie Covid-19 (coronavirus infectious disease 2019), l’accent a été mis au début de la pandémie sur une transmission de proximité, contact direct de personne à personne, par les surfaces et par la projection directe de grosses gouttelettes émises par une personne infectée, tandis que la transmission par voie aérosol était peu envisagée. En effet, le taux de reproduction de la Covid-19 (R0 compris entre 1,4 et 8,9) était considéré comme incompatible avec une transmission par voie aérosol, car beaucoup plus faible que le taux de reproduction d’autres maladies à transmission par voie aérosol, comme par exemple la rougeole (R0 compris entre 12 et 18) [1].Dès avril 2020, s’appuyant sur les publications montrant que le virus SARS-CoV-2 était retrouvé dans l’air des chambres de patients infectés et sur les études montrant la conservation du potentiel infectieux de ce virus durant plus de 1 heure après aérosolisation, cette voie de transmission a été considérée comme très probable par le Haut Conseil de la santé publique [2], conduisant à la recommandation du port du masque dans les environnements intérieurs. Cette recommandation avait notamment pour objet de contenir les émissions oropharyngées et d’éviter la mise en suspension d’aérosols infectieux dans les environnements intérieurs. La démonstration de cette transmission par voie aérosol a été possible par la suite grâce à l’étude d’événements particuliers, de type cluster en environnements intérieurs, pour lesquels les autres voies de transmission (contact direct, projections et fomites) étaient insuffisantes pour expliquer l’ensemble des contaminations observées [3, 4]. Actuellement, la contribution d’une transmission par voie aérosol n’est plus remise en cause, et certaines études avancent que cette voie de transmission pourrait même être majoritaire [4].
Cette crise sanitaire a mis en lumière les ambiguïtés engendrées par la classification mode « gouttelettes » et mode « aérosol » qui est utilisée dans le domaine médical pour définir les mesures de protection à adopter. En effet, cette transmission en mode « gouttelettes » est un mode de transmission qui a lieu lorsque la personne infectée et la personne exposée sont à courte distance (inférieure à 1-2 m), or à cette distance l’exposition aux aérosols émis (gouttes de taille inférieure à 100 mm et résidus secs) est également importante. De plus, cette période a été l’occasion de remettre en question, de clarifier et d’unifier le vocabulaire utilisé par les différentes communautés scientifiques, notamment en ce qui concerne le terme « aérosol » dont les définitions variaient d’une publication à l’autre (particules de diamètre inférieur à 5 mm dans certaines publications et 10 mm dans d’autres), alors que le terme est parfaitement défini depuis de nombreuses années par la communauté des scientifiques travaillant dans le domaine (voir, par exemple, le site de l’Association Française d’Etudes et de Recherches sur les Aérosols [5]) comme étant une suspension, dans un milieu gazeux, de particules solides et/ou liquides dont le d
iamètre est inférieur à 100 µm, limite conventionnelle pour laquelle les particules ont un temps de résidence en suspension dans l’air suffisamment long et sont inhalables. Avec cette définition, on voit que le terme gouttelettes utilisé en opposition à aérosol est problématique puisque les gouttelettes peuvent former un aérosol.
Le processus de transmission aéroporté d’un virus implique trois étapes principales [6] : un processus d’émission lors de l’exhalaison, un transfert (transport vers la personne exposée) puis une inhalation par la personne exposée. Pour déclencher la maladie, il faut que tout au long de ces processus le virus reste infectieux et que l’inhalation du virus permette d’atteindre les sites cibles du virus. Ce processus est complexe et implique de nombreux mécanismes physicochimiques, biologiques et physiologiques qui sont résumés dans les paragraphes suivants.
Les mécanismes de la transmission aéroportée des virus respiratoires
Lorsqu’une personne respire, parle, crie, chante, tousse ou éternue, elle émet un jet d’air humide, chaud et turbulent par le nez et/ou la bouche. Les vitesses d’air en sortie du nez ou de la bouche sont d’environ 1 m/s pour la respiration, environ 5 m/s pour la vocalisation et jusqu’à 10 m/s pour une toux. Ce flux d’air transporte des gouttes de salive et de mucus de taille comprise entre 100 nanomètres (nm) et plus de 100 micromètres (µm). Elles sont principalement composées d’eau, de sels, de composés organiques et éventuellement de virus ou de bactéries. Ces gouttes sont générées par différents mécanismes dans l’arbre respiratoire [7] :
- par les forces de cisaillement produites par l’écoulement d’air sur le fluide tapissant les voies respiratoires à l’inspiration et à l’expiration ;
- par la déstabilisation du fluide lors de la réouverture de petites voies aériennes et des alvéoles pendant la respiration ;
- par l’émission de mucus recouvrant les cordes vocales due à l’adduction et aux vibrations de celles-ci lorsqu’une personne parle ou chante ;
- par l’émission de gouttes de salive due aux mouvements de la bouche, des lèvres et de la langue.
La granulométrie (distribution en taille) et le nombre de gouttes émises en fonction du type d’exhalaison ont fait l’objet d’études depuis de nombreuses années, avec cependant une dispersion dans les résultats assez importante provenant, d’une part, de la variabilité interindividus et, d’autre part, des méthodes expérimentales très variées utilisées [8]. Le nombre de virus présents dans les gouttes émises dépend de la concentration en virus dans le fluide mis en suspension (salive ou mucus). Cette concentration est bien entendu très variable et dépend du virus, de la phase de la maladie et de l’individu. Une revue bibliographique très complète recensant les différentes données issues de la littérature concernant la taille, le taux d’émission et le contenu en virus a été réalisée récemment par Wang et al. [1].
Après émission, les gouttes peuvent sécher conduisant à la formation de résidus secs d’un diamètre d’environ deux à quatre fois inférieur à la taille de la goutte initiale (une goutte de 40 µm donne un résidu de diamètre compris entre 10 et 20 µm). Une revue bibliographique sur le sujet a été faite récemment par Bagheri et al. [9]. Les grosses gouttes (supérieures à 100 mm) vont être projetées ou sédimenter sur les surfaces alentour (y compris les muqueuses d’une personne qui serait à proximité). Les gouttes de diamètre compris entre environ 50 mm et 100 mm vont être entraînées dans le jet d’émission mais du fait de leur poids vont rapidement se déposer sur les surfaces alentour. Il faut noter cependant que ces particules peuvent être inhalées par une personne qui se trouverait à proximité (à une distance inférieure à 1-2 m). Les gouttes de diamètre inférieur à environ 50 mm vont sécher très rapidement (à titre indicatif une goutte d’eau pure de 25 mm de diamètre met 1 seconde pour s’évaporer dans l’air ambiant) et former des résidus secs. Ces résidus secs, dont le poids est très inférieur à celui des gouttes d’origine, peuvent être transportés à plus longue distance et inhalés par une personne.
La transmission par voie aérosol peut être classifiée en quatre catégories :
- transmission en champ proche (short range airborne transmission) : lorsque la personne infectée et la personne exposée sont à une distance inférieure à 1-2 m, sans obstacle. Dans ce cas, les flux respiratoires des deux individus sont très rapprochés, et la concentration en aérosols est maximum. En champ proche, la personne exposée peut inhaler des gouttes en cours de séchage et des résidus secs ;
- transmission en champ lointain dans une même pièce (shared-room airborne transmission) : lorsque la personne infectée et la personne exposée sont à une distance supérieure à 1-2 m mais dans une même pièce. Dans ce cas, l’exposition aux aérosols contenant des virus va dépendre très fortement de la taille de la pièce, de l’hygrométrie, des flux d’air dans la pièce et des conditions de ventilation. Dans ce cas, comme dans les cas suivants, l’aérosol viral est composé uniquement de résidus secs ;
- transmission en champ lointain dans des pièces différentes d’un même bâtiment : dans ce cas, les aérosols émis peuvent se disperser dans le bâtiment en fonction des flux d’air présents et/ou être redistribués par les systèmes de ventilation ;
- transmission en champ très lointain (longer distance airborne transmission) : dans ce cas, les aérosols sont emportés par des panaches d’air issus de systèmes d’aération (ou autres flux d’air) et vont entrer dans un autre bâtiment à proximité. Ce mode de transmission a été rapporté dans un complexe d’appartements à Hong-Kong en 2003 [10].
Une fois transféré à proximité de la personne exposée, l’aérosol va pouvoir être inhalé. Dans ce cas, il est entraîné dans les voies respiratoires, et les particules peuvent se déposer à différents niveaux en fonction de leur taille (modèle International Commission on Radiological Protection [11]). L’efficacité de dépôt dans les différentes zones de l’appareil respiratoire dépend de plusieurs mécanismes physiques (impaction inertielle, sédimentation, interception, diffusion brownienne, etc.) et des paramètres anatomiques et physiologiques (nature de l’activité respiratoire, par exemple, respiration calme ou profonde, etc.). La figure 1, basée sur le modèle ICRP 66, montre que les particules de diamètre compris entre 50 et 100 μm vont pouvoir se déposer dans la partie extrathoracique mais ne peuvent pas se déposer dans la partie trachéobronchique et alvéolaire, tandis que les particules de 1 mm vont se déposer majoritairement dans les voies supérieures mais peuvent également se déposer dans la zone alvéolaire et dans une moindre mesure dans la zone trachéobronchique. Contrairement à ce qui est souvent indiqué dans la littérature, il est faux de dire que plus les particules sont petites plus elles peuvent atteindre les zones profondes de l’arbre respiratoire sans limite sur les tailles considérées. En effet, on voit par exemple qu’en dessous de 10 nanomètres les particules se déposent de moins en moins dans la zone alvéolaire au profit d’un dépôt dans la partie extrathoracique du fait du mouvement brownien.
Pour que la transmission de la maladie soit effective, il faut donc que les particules transportant du virus soient inhalées et déposées sur une zone de l’arbre respiratoire réceptive au virus et en quantité suffisante pour déclencher la maladie.
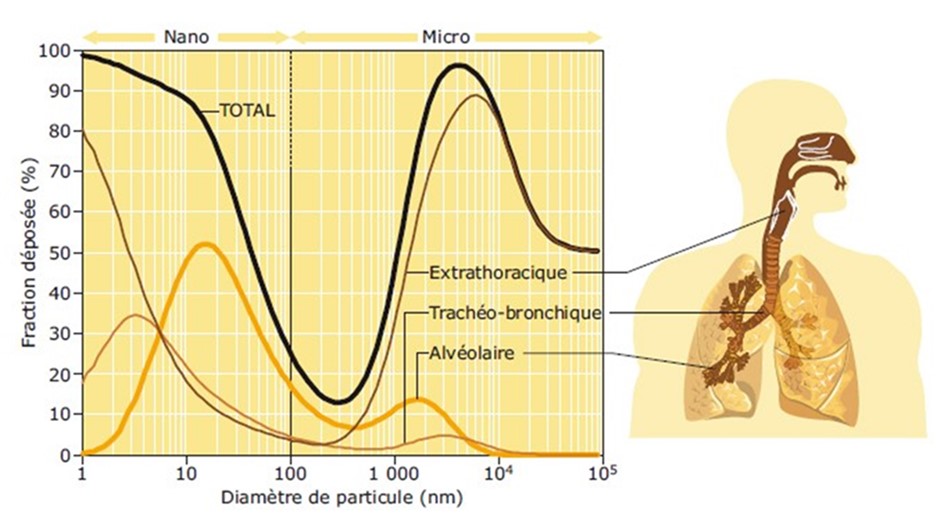
Figure 1. Fraction de particules déposées en fonction de la taille des particules
(Copyright © Illustratek pour l’INRS, reproduction autorisée par l’INRS).
Les mesures de protection d’une transmission virale aéroportée en environnements intérieurs
Le Haut Conseil de la santé publique a défini une doctrine sanitaire de prévention contre la transmission des viroses respiratoires reposant sur sept mesures barrières à appliquer lors d’une circulation active du virus dans la population [12]. La réduction maximale du risque de transmission est atteinte lorsque les sept mesures sont associées simultanément. Parmi ces mesures barrières, quatre d’entre elles ont pour objet de réduire la transmission aéroportée ; il s’agit de deux mesures individuelles, dépendant du comportement des personnes, et de deux mesures collectives ou environnementales, dont la mise en œuvre relève de décisions administratives ou de consignes réglementaires ou de la responsabilité des gestionnaires de bâtiments :
- 1. Le respect de la distanciation physique interindividuelle de 2 mètres : cette mesure permet d’éviter la transmission par projection directe de grosses gouttes et d’éviter de se trouver dans la zone où la concentration en aérosols est la plus élevée, ce qui limite de fait la transmission par voie aérosol en champ proche ;
- 2. Le port d’un masque efficace, respirant et bien ajusté, dès l’âge de 6 ans dans tous les établissements recevant du public, en espace clos, le plus longtemps possible. Cette mesure permet de bloquer une grande partie des gouttes dès leur émission et d’éviter qu’elles forment des résidus secs pouvant se disperser dans les environnements intérieurs (réduction de la contamination à la source). Le masque protège également, dans une certaine mesure suivant son type, celui qui le porte d’une partie des aérosols viraux éventuellement présents dans l’air ;
- 3. Le renouvellement de l’air des locaux par apport d’air neuf extérieur, qui assure la dilution et l’élimination des aérosols viraux. La mesure du CO2, émis par la respiration humaine, est utilisable comme indicateur du renouvellement de l’air dans un espace clos sans processus de combustion. Une valeur supérieure à 800 ppm doit conduire à agir en termes d’aération/ventilation et/ou de réduction du nombre de personnes présentes ;
- 4. La gestion de la densité de personnes dans un espace clos. Cette mesure permet de réduire statistiquement la possibilité qu’une personne infectée soit présente et si une personne infectée est présente de réduire le nombre de personnes exposées aux aérosols.
Références
[1] Wang CC, Prather KA, Sznitman J, et al. Airborne transmission of respiratory viruses. Science 2021 ; 373 : eabd9149.
[2] HCSP. Coronavirus SARS-CoV-2 : risque de transmission du virus sous formes d’aérosols en milieu intérieur et extérieur, Rapport de l’HCSP. Paris : Haut Conseil de la santé publique, 2020.
[3] Morawska L, Milton DK. It Is Time to Address Airborne Transmission of Coronavirus Disease 2019 (COVID-19). Clin Infect Dis 2020 ; 71 : 2311-3.
[4] Peng Z, Rojas ALP, Kropff E, et al. Practical Indicators for Risk of Airborne Transmission in Shared Indoor Environments and Their Application to COVID-19 Outbreaks. Environ Sci Technol 2022 ; 56 : 1125-37.
[5] ASFERA - Association Française d’Etudes et de Recherches sur les Aérosols. https://www.asfera.org/fr
[6] Le Cann P, Wallet F. Covid-19 et transmission par aérosols : état des lieux. Environnement Risques et Santé 2021 ; 20 : 290-4.
[7] Morawska L, Johnson GR, Ristovski ZD, et al. Size distribution and sites of origin of droplets expelled from the human respiratory tract during expiratory activities. J Aerosol Sci 2009 ; 40 : 256-69.
[8] Mahjoub Mohammed Merghani K, Sagot B, Gehin E, Da G, Motzkus C. A review on the applied techniques of exhaled airflow and droplets characterization. Indoor Air 2021 ; 31 : 7-25.
[9] Bagheri G, Schlenczek O, Turco L, et al. 2021. Exhaled particles from nanometre to millimetre and their origin in the human respiratory tract. medRxiv, 2021. https://doi.org/10.1101/2021.10.01.21264333
[10] Yu IT, Li Y, Wong TW, et al. Evidence of airborne transmission of the severe acute respiratory syndrome virus. N Engl J Med 2004 ; 350 : 1731-9.
[11] ICRP, 1994. Human Respiratory Tract Model for Radiological Protection. ICRP Publication 66. Ann. ICRP 24 (1-3).
[12] HCSP. Le point sur La Covid-19, 2020. https://www.hcsp.fr/Explore.cgi/PointSur?clef=2



